© 2022 Николай Владимирович ГОЛОБОРОДЬКО, Екатерина Ивановна ДУНАЕВА
МАиБ – 1(23) 2022
DOI: https://doi.org/10.33876/2224-9680/2022-1-23/05
Ссылка при цитировании:
Голобородько Н.В., Дунаева Е.И. (2022) Доступность вакцинации от COVID-19: мировой опыт и ситуация в Беларуси, Медицинская антропология и биоэтика, № 1(23).
 Николай Владимирович Голобородько –
Николай Владимирович Голобородько –
.
кандидат медицинских наук,
доцент кафедры педиатрии
Белорусской медицинской академии
последипломного образования
(Минск, Республика Беларусь)
.
https://orcid.org/0000-0003-1912-5471
E-mail: halabarodzka@gmail.com
.
старший преподаватель кафедры педиатрии
Белорусской медицинской академии последипломного образования
(Минск, Республика Беларусь)
.
https://orcid.org/0000-0003-0779-925X
.
E-mail: dunayevaekaterina@gmail.com
Ключевые слова: COVID-19, Беларусь, вакцины, доступ, доступность, охват вакцинацией, национальная политика иммунизации, низкопороговые сервисы, одобрение экстренного использования, механизм COVAX, прогнозируемые потребности
Аннотация: В статье перечислены условия, влияющие на доступность вакцинации от COVID-19. Приведена краткая характеристика производителей и самих вакцин от COVID-19, лидирующих по использованию в клинической практике. Представлен анализ текущей ситуации с доступом к вакцинам от COVID-19, а также к рутинной вакцинации в мире и в Беларуси. Рассмотрены отдельные способы повышения доступа к вакцинам: рекомендованный ВОЗ механизм одобрения экстренного использования вакцин и его реализация в Беларуси, механизм COVAX для обеспечения равной доступности вакцин в странах с разным уровнем дохода, градация приоритетности предоставления вакцин отдельным категориям населения, а также снижение порога доступа к вакцинации. Обсуждены ближайшие перспективы потребности в вакцинах от COVID-19, возможности использования опыта борьбы с пандемией (новые технологические платформы производства вакцин, ускоренный вывод вакцин на рынок, межстрановые взаимодействия) при решении других задач в области медицины, в том числе в устранении глобального дефицита вакцин от прочих заболеваний.
Вакцинация как программа общественного здравоохранения
Польза вакцинации выходит за рамки профилактики конкретных заболеваний у отдельных людей. Велико общественное значение вакцинации: она позволяет защищать окружающих (формируя коллективный иммунитет), экономить время и деньги (снижая бремя заболеваний и связанные с ними затраты на здравоохранение и утрату трудоспособности), устранять неравенство (внедряя схожие программы среди разных социальных групп по всему миру), защищать будущие поколения (управляя инфекциями до их элиминации – снижения заболеваемости определенной инфекционной болезнью до нуля в границах определенной территории – и даже ликвидации). Социальная польза вакцинации от COVID-19 также включает безопасность путешествий и мобильность (еще недавно сертификаты о вакцинации требовались для въезда на территорию большинства стран мира), а также заботу о пожилых людях – именно они явились приоритетной группой для предоставления вакцин на старте программ вакцинации. И, наконец, важным результатом глобального внедрения программ вакцинации явилось построение медицинской инфраструктуры в развивающихся странах.
В медицинской среде обсуждается возможность сформировать коллективный иммунитет от COVID-19 с помощью вакцинации. Исходя из оценки быстроты распространения вируса в начале пандемии (R0= 2,5), для прекращения его циркуляции следовало достичь уровня коллективного иммунитета около 60% (его обеспечивают лица, приобретшие иммунитет как в результате перенесенной инфекции, так и в результате вакцинации). Демонстрируемая в исследованиях эффективность вакцин на уровне 65–95% по сероконверсии (выработке специфических антител в сыворотке крови в результате инфекции или иммунизации, включая вакцинацию) позволяла рассчитывать на создание коллективного иммунитета при широком охвате вакцинацией. Однако получившие глобальное распространение новые, быстрее распространяющиеся варианты – вариант дельта (R0= 5,8) и омикрон (R0> 6,0) – для формирования коллективного иммунитета требуют достижения 83% и более иммунных лиц в популяции, что затрудняет задачу и требует существенно больших охватов вакцинацией.
Мы как общество действуем коллективно для обеспечения условий, в которых люди будут здоровы. При этом Национальные программы иммунизации, как и другие программы общественного здравоохранения, признают приоритетность здоровья общества над автономией решений отдельной личности (при строго определенных условиях и с соответствующими ограничениями). Одним из условий, оправдывающих существование программ общественного здравоохранения, является их наименьшее посягательство – то есть введение обязательных мер только в немногочисленных, четко определенных ситуациях. До пандемии COVID-19 вакцинация в ряде случаев являлась обязательной для путешественников: прививка от желтой лихорадки требовалась для въезда в некоторые страны Африки, а прививка от менингококковой инфекции ACWY – для паломников на хадж в города Умра, Мекка и Медина (WHO 2005). После начала пандемии COVID-19 сертификат о вакцинации мог быть альтернативой получения путешественником отрицательного ПЦР теста на SARS-CoV-2 и/или нахождения его в изоляции. Плановую вакцинацию в рамках Национального календаря прививок и Перечня прививок по эпидемиологическим показаниям в Беларуси проводят на добровольной основе после получения устного информированного согласия человека (Закон «О здравоохранении»).
Условия, определяющие охват вакцинацией
Условия, определяющие охват вакцинацией, многочисленны, но для удобства могут быть сгруппированы в пять блоков: от физической и экономической доступности вакцины в стране, осведомленности и намерения человека привиться, до таких заключительных подталкивающих к вакцинации действий, как отправка текстового сообщения или звонок медсестры из поликлиники (таблица 1).
Таблица 1. Пять «A», определяющие использование вакцины (Thomson et al. 2016:1018)
| 1 | Access | Доступ (вакцина есть) | Физическое наличие вакцины в стране |
| 2 | Affordability | Доступность (я могу себе позволить) | Возможность привиться – экономическая и логистическая |
| 3 | Awareness | Осведомлённость (я знаю о вакцине) | Знания о пользе вакцины и о возможности привиться |
| 4 | Acceptance | Принятие (я хочу привиться) | Намерение привиться |
| 5 | Activation | Активация (я прививаюсь) | Действия, подталкивающие сделать последний шаг к прививке |
Обеспечение физического доступа включает наличие регистрации вакцины в стране (включение ее в национальный реестр лекарственных средств), возможность поставок и цену, планирование и проведение централизованных закупок вакцины, а также распределение и доставку ее в отдельные учреждения, проводящие вакцинацию.
Обеспечение экономической доступности предполагает бесплатное предоставление вакцины в случае ее включения в Национальную программу иммунизации либо приемлемую для граждан стоимость вакцины в случае ее приобретения за собственные средства.
Обеспечение логистической доступности предполагает определение порядка вакцинации, наличие вакцин в местах проведения вакцинации (например, в поликлинике или медицинских пунктах школ и предприятий) и удобный для граждан режим работы.
Производство вакцин
В отличие от лекарственных средств, получаемых путем химического синтеза, иммунобиологические лекарственные средства требуют более сложных условий производства. До начала пандемии COVID-19 во всем мире имелось весьма ограниченное количество вакцинных производств, мощности которых не успевали за все возрастающими потребностями стран в вакцинах. Наблюдался глобальный дефицит вакцин, рос спрос на недорогие вакцины со стороны развивающихся рынков (WHO 2016).
В 2017 году около 90% мирового рынка вакцин примерно в равных частях делили четыре фармацевтических гиганта: GlaxoSmithKline (Соединенное королевство), Merck & Co (США), Pfizer (США) и Sanofi Pasteur (Франция). В последующие годы произошел стремительный рост числа новых производителей, а также снижение стоимости выпускаемых вакцин. Так, на конец 2019 года около 60% вакцин в мире производили в Индии, появились новые объединения фармацевтических компаний, например, Сеть производителей вакцин в развивающихся странах (DCVMN 2021) и Ассоциация производителей вакцин Индии, объединяющая такие компании как Serum Institute of India, Bharat Biotech, Panacea Biotec и Biological Evans (IVMA 2022).
Классические технологии, используемые при производстве большинства вакцин, сопряжены со значительными временны́ми затратами. Например, производство сезонных инактивированных вакцин от гриппа, требующих роста вируса на куриных эмбрионах, занимает несколько месяцев. А полный цикл изготовления и проведения контроля качества 5- или 6-компонентных вакцин занимает несколько лет. Поэтому от менеджеров Национальных программ иммунизации требовалось заранее проводить долгосрочное планирование потребностей в вакцинах.
Пандемия COVID-19 явилась вызовом для быстрого реагирования на изменяющиеся потребности в вакцинах, поскольку одномоментно возникла огромная глобальная потребность в них, а дальнейшее планирование потребностей осложнялось быстро меняющимися рекомендациями по тактике последующей вакцинации.
На данный вызов откликнулось большое число компаний по всему миру. Производственные мощности были предоставлены в том числе совершенно новыми, ранее широко не известными производителями вакцин. Например, компания Moderna, которая с 2011 года начала исследования в области производства лекарств на основе мРНК, уже к концу 2021 года выпустила более 800 млн доз вакцины от COVID-19, или компания BioNTech, которая за 2021 год совместно с компанией Pfizer поставила 2,6 млрд доз в 165 стран мира (Moderna 2022; BioNTech 2021).
Вакцины-кандидаты от COVID-19 были созданы на разнообразных платформах: не только классических, но также и инновационных (например, на основе нереплицирующихся аденовирусных векторов или на основе мРНК), что привело к снижению сроков их производства и удешевлению. Сведения об основных вакцинах от COVID-19 приведены в Таблице 2. Актуальное состояние вакцин, вышедших на рынок, а также находящихся в доклинических и клинических испытаниях, можно отслеживать на различных ресурсах (WHO 2022; NYT 2021).
Таблица 2. Вакцины от COVID-19, лидирующие по использованию в клинической практике, по состоянию на 19.05.2022 (NYT 2021)
| Производитель (вакцина) | Тип вакцины | Разрешение/ Одобрение | ||
| (ЕMA 2021) | (WHO 2021a) | Беларусь | ||
| Pfizer-BioNTech (Comirnaty) | мРНК | Да | Да | |
| Moderna (Spikevax) | Да | Да | ||
| Институт Гамалеи (Спутник V) | Векторная | — | — | Да* |
| Oxford-AstraZeneca (Vaxvevria, Covishield) | Да | Да** | ||
| CanSino (Convidecia) | — | — | ||
| Johnson& Johnson (Janssen Ad26.COV2.S) | Да | Да | ||
| Novavax (Covovax, Nuvaxovid) | Белковая | Да | Да*** | |
| НПО Вектор (Эпивак Корона) | — | — | ||
| Finlay Vaccine Institute (Soberana 02) | — | — | Да | |
| Sinopharm-Beijing IBP (BBIBP-CorV) | Инактиви-рованная | — | Да | Да**** |
| SinoVac (CoronaVac) | — | Да | ||
| Bharat Biotech (Covaxin) | — | Да | ||
| ФНЦ Чумакова (КовиВак) | — | — | ||
Примечания: *допущена к медицинскому применению по процедуре условной регистрации; **в том числе производства SK Bioscience (Корея) и Serum Institute of India (Covishield, Индия); ***в том числе производства Serum Institute of India (Covovax, Индия); ****выдано единовременное разрешение на ввоз и медицинское применение.
В Беларуси на базе Республиканского научно-практического центра эпидемиологии и микробиологии разработан прототип отечественной инактивированной вакцины от COVID-19, в настоящее время идет этап масштабирования промышленного производства. Помимо этого, национальный фармпроизводитель Белмедпрепараты совместно с институтом Гамалеи освоил производство вакцины Гам-Ковид-Вак (Спутник V).
Одобрение экстренного использования вакцин
Стандартная процедура выдачи разрешения на медицинское применение (государственная регистрация) нового лекарственного препарата, в том числе новой вакцины, является достаточно долгой. Требуется получение результатов клинических исследований: I фазы – установления безопасности вакцины на небольшом числе здоровых добровольцев, II фазы – установления иммуногенности и безопасности вакцины на большем числе участников, и, наконец, III фазы – установления клинической эффективности и безопасности вакцины, проведенное на нескольких десятках тысяч людей. Ранее этот процесс занимал в среднем от 5 до 7 лет.
В условиях быстрого распространения COVID-19 и невозможности остановить пандемию имеющимися методами контроля в виде нефармацевтических интервенций (соблюдения респираторного этикета, социального дистанцирования и изоляции заболевших) как можно более быстрый вывод вакцин на рынок являлся приоритетным для спасения жизней людей. В связи с этим, сроки проведения клинических исследований вакцин были сокращены до 1–1,5 лет, а отдельные страны и международные организации широко внедрили ранее разработанный механизм Emergency Use Authorization – выдачи «одобрения на экстренное использование» вакцин (в ряде источников также встречается термин «одобрение на использование в чрезвычайных ситуациях»). Всемирная организация здравоохранения (ВОЗ) использовала такой механизм еще во время вспышки лихорадки Эбола в 2014–2016 годах, а также внедрила его после объявления чрезвычайной ситуацией пандемии COVID-19 (WHO 2020a; WHO 2021a).
Одобрение экстренного использования получают вакцины, которые еще не завершили III фазу клинических испытаний, но их вероятный профиль эффективности и безопасности может быть оценен как благоприятный. Одобрение экстренного использования по сути является временным, и после его получения следует продолжить клинические испытания вакцины в соответствии с планом, для последующей выдачи стандартного разрешения на медицинское применение.
В Беларуси регламентирована процедура условной государственной регистрации лекарственных препаратов (Закон «Об обращении лекарственных средств»), по которой в 2020 году была зарегистрирована вакцина Гам-КОВИД-Вак (Спутник V) как средство для медицинской профилактики жизнеугрожающих заболеваний (Реестр лекарственных средств 2021); предусмотрена выдача регистрационного удостоверения со сроком действия один год и последующим ежегодным его подтверждением. В 2021 году в Беларуси было введено понятие «стратегически важных лекарственных препаратов», к которым в том числе отнесены препараты для использования в чрезвычайных ситуациях, и регламентированы вопросы их государственной регистрации (постановление Совмина № 570). Чрезвычайная ситуация определена как «обстановка, сложившаяся на определенной территории в результате промышленной аварии, иной опасной ситуации техногенного характера, катастрофы, опасного природного явления, стихийного или иного бедствия, которые повлекли или могут повлечь за собой человеческие жертвы, причинение вреда здоровью людей или окружающей среде, значительный материальный ущерб и нарушение условий жизнедеятельности людей, а также отсутствие или угроза отсутствия на территории Республики Беларусь стратегических препаратов». Условная регистрация стратегически важных лекарственных препаратов для экстренного применения проводится в срок до 7 дней (либо до 15 дней в случае направления запроса в другие организации).
Включение вакцин от COVID-19 в Национальные программы иммунизации
Решение о включении новой вакцины в Национальную программу иммунизации принимают с учетом наличия потребности в контроле инфекции, имеющихся доказательств пользы от вакцинации, доступности вакцины в стране и готовности общества принять эту вакцину. Обоснование целесообразности включения новой вакцины для лиц, определяющих национальную политику иммунизации, могут проводить национальные технические консультативные группы (экспертные советы) по иммунизации.
В Беларуси проведение вакцинации в рамках Национального календаря профилактических прививок и Перечня профилактических прививок по эпидемическим показаниям осуществляется в рамках оказания медицинской помощи гражданам и полностью финансируется государством. Вакцинация от COVID-19 в 2021 году была включена в Национальную программу иммунизации: для взрослого населения (постановление Минздрава № 109), беременных (приказ Минздрава № 1257) и детей в возрасте от 12 до 17 лет (приказ Минздрава № 1615).
Приоритетность предоставления вакцин от COVID-19
Непосредственно после выхода на рынок вакцин от COVID-19 встал вопрос о порядке приоритетности их предоставления отдельным категориям лиц.
Рекомендации Стратегической консультативной группы экспертов ВОЗ по иммунизации (SAGE) включали шесть основных принципов, которыми следует руководствоваться при распределении вакцин и определении приоритетности вакцинации: благополучие населения, глобальная справедливость, взаимность, равное уважение, национальная справедливость, легитимность (WHO 2020b). Для оказания поддержки странам в планировании распределения вакцин ВОЗ разработала Дорожную карту приоритезации для различных уровней доступности вакцин и различных эпидемиологических условий (WHO 2020c). Было предложено выделять целевую группу первого приоритета (медицинские работники, полиция и военные, работники служб жизнеобеспечения), второго приоритета (лица ≥80 лет, лица 60–79 лет с наличием или без сопутствующей патологии, беременные) и, наконец, третьего приоритета (здоровые взрослые 20–59 лет, подростки и дети 5–19 лет, дети первых 4 лет).
Аналогичная тактика была применена и в Беларуси: на первом этапе предлагалось провести вакцинацию медицинских и фармацевтических работников, работников социальной сферы и сферы образования, а также взрослых, проживающих в учреждениях с круглосуточным режимом пребывания; на втором этапе – лиц в возрасте ≥60 лет и лиц с хроническими заболеваниями как имеющих высокий риск тяжелого течения COVID-19; на третьем этапе – вакцинацию лиц, имеющих высокий риск заражения инфекцией COVID-19 по сравнению с остальным населением в связи с их профессиональной деятельностью (работники торговли, общественного питания, бытового обслуживания, транспорта, учреждений культуры, спортивных учреждений и другие), а также работников государственных органов, обеспечивающих безопасность государства и жизнедеятельность населения (Минздрав 2020). Рекомендации по вакцинации беременных были внедрены сразу после появления предварительных данных об их безопасности. После предоставления вакцинации лицам, наиболее подверженным риску заражения и тяжелого течения COVID-19, доступ к вакцинации был распространен на все группы населения, включая подростков.
Обеспечение глобальной доступности вакцин от COVID-19
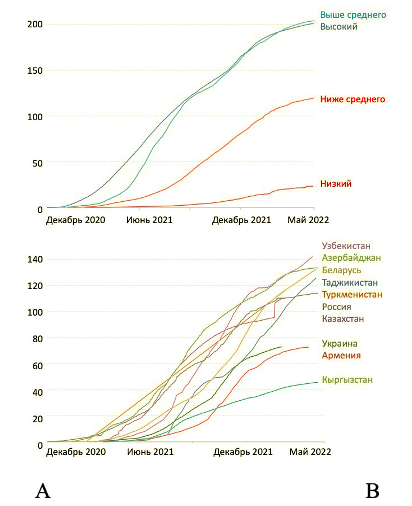
Современный охват вакцинацией от COVID-19 значительно различается в зависимости от уровня дохода стран (Рис. 1А). Но он может быть разным и в странах со схожим уровнем дохода, как это видно на примере государств региона ВЕЦА (Рис. 1В).
Еще до начала пандемии COVID-19 некоторые международные организации имели опыт работы по оказанию помощи странам в закупке вакцин: от переговоров с производителями о ценах до проведения закупок на международных площадках за собственные средства. Так, Глобальный альянс по вакцинам (GAVI) и Детский фонд ООН (ЮНИСЕФ) работают с целью создания равного доступа к новым и недостаточно используемым вакцинам для детей, живущих в беднейших странах мира. Сейчас почти половина всех детей в мире вакцинируются при поддержке GAVI, и недавно альянс расширил свой мандат на страны со средним уровнем дохода.
Сразу после начала пандемии COVID-19 была создана Инициатива по ускорению доступа к средствам для борьбы с COVID-19 (ACT), которую координирует Коалиция за инновации в области обеспечения готовности к эпидемиям (CEPI), GAVI и ВОЗ. В рамках данной инициативы работает программа COVAX, которая направлена на поддержку исследований, разработки и производства широкого спектра вакцин-кандидатов от COVID-19, на переговоры с производителями о снижении цен, а также на обеспечение разумной доступности вакцин в различных регионах мира на основе принципа «богатые страны платят за бедных» (GAVI 2022).
Снижение порога доступа для прохождения вакцинации
Национальная политика иммунизации предполагает обеспечение мер для широкого охвата вакцинацией, в том числе по сокращению логистических барьеров доступа.
Для поддержания низкопорогового доступа к вакцинам в городах Беларуси были развернуты пункты вакцинации вне лечебных учреждений. Сделать прививку стало возможно в торговых центрах, на рынках, вокзалах, станциях метро. Пункты вакцинации работают в том числе в выходные дни, их посещение не требует предварительной записи, их можно посетить всей семьей или за компанию (Комитет по здравоохранению… 2022).
В качестве одной из мер обеспечения доступа к вакцине было предложено матерям (в том числе кормящим грудью) сделать прививку от COVID-19 в детской поликлинике при плановом посещении педиатра.
Доступность плановой вакцинации в период пандемии
Пандемия COVID-19 повлияла на оказание всей плановой медицинской помощи, в том числе на реализацию программ вакцинации. В начале пандемии в большей части стран Европы была сохранена плановая вакцинация детей до 2 лет, но приостановлена вакцинация старших детей. В Беларуси в марте 2020 года с началом пандемии плановую вакцинацию взрослого и детского населения было рекомендовано ограничить с учетом имеющихся возможностей (в ряде поликлиник она была приостановлена), но уже с начала июня проведение плановых прививок было возобновлено в полном объеме. В настоящее время ВОЗ рекомендует проводить все плановые профилактические прививки во время пандемии COVID-19 в соответствии с графиком. Возможный контакт с источником инфекции не является противопоказанием для проведения плановой иммунизации. Лица, перенесшие COVID-19, могут получать плановые прививки сразу после разрешения клинических проявлений заболевания и завершения периода изоляции.
Вакцинация от гриппа и пневмококка рекомендована как интегральный компонент подготовки к последующим волнам пандемии COVID-19, поскольку вероятно наслоение пиков заболеваемости гриппом и коронавирусной инфекцией, отмечается схожесть групп риска тяжелого течения обеих инфекций (пожилые, лица с сопутствующей соматической патологией, включая ожирение, лица находящиеся в учреждениях длительного пребывания), описаны более тяжелое течение COVID-19 при ко-инфекции с гриппом и высокая частота банальных пневмококковых пневмоний в исходе обеих вирусных инфекций.
Прогнозируемая потребность в вакцинах от COVID-19
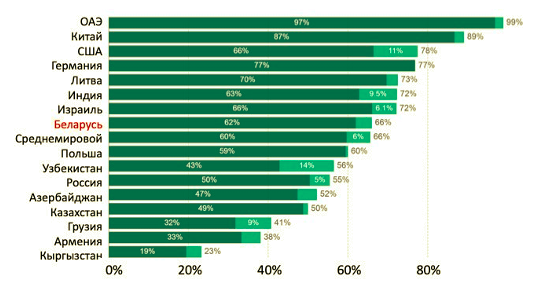
Программы вакцинации от COVID-19 в отдельных странах разворачивались с разной скоростью, и охват вакцинацией в настоящее время оказался различным (Рис. 2). Тем не менее, первичные дозы вакцины и один бустер получили около двух третей населения планеты. А с учетом того, что вакцинация детей в большинстве регионов мира только начинается, доля привитого взрослого населения глобально может составить около 80%.
Объем потребности в вакцинах от COVID-19 в ближайшее время будет зависеть от выбранной тактики их дальнейшего использования (Offit 2022). Так, вероятно программа вакцинации от COVID-19 будет распространена на детское население: в ряде стран прививают подростков и детей старше пяти лет, в некоторых странах (ОАЭ, Китай) уже разрешено применение вакцин детям, начиная с трех лет, проходят клинические испытания эффективности и безопасности вакцинации у детей от 6 месяцев.
Буквально до недавнего времени было неясно, определят ли национальные и международные рекомендации необходимость регулярного введения повторных бустерных доз, или будет признана достаточной схема из первичных доз и одной бустерной. Длительно сохраняющийся после введения первого бустера Т-клеточный ответ может обеспечить многолетнюю защиту от тяжелого заболевания. В то же время, если мы хотим сформировать защиту от любого случая заболевания, следует обеспечить постоянное сохранение защитного титра антител, что может быть достигнуто только при введении повторных бустеров. К настоящему времени большинство стран рассматривает введение по крайней мере одного повторного бустера (например, в США – лицам старше 50 лет, в Беларуси – всем категориям лиц, подлежащим иммунизации), и в последующем эти рекомендации будут корректироваться.
Также пока неясно, станет ли COVID-19 сезонной респираторной инфекцией уже в этом сезоне и насколько антигенный состав вируса будет меняться от сезона к сезону (например, как сдвиговые мутации у вируса гриппа). Пока все получившие глобальное распространение варианты вируса (предшественник, альфа, дельта, омикрон и его подварианты) эффективно нейтрализуются поствакцинальными антителами, однако в последующем не исключены более выраженные мутации вируса, которые могут привести к необходимости изменения антигенного состава вакцин и проведения повторной вакцинации.
Вакцины на основе мРНК как новая перспективная платформа
Уже в начале 2021 г. были озвучены опасения, что в результате дефицита производства и поставок вакцин, накапливания запасов вакцин богатыми странами и стремления компаний в приоритетном порядке обслуживать правительства, способные закупать продукцию по самой высокой цене, страны с низким и средним уровнем дохода могут оказаться на последних местах в очереди на получение вакцин от COVID-19. В этих обстоятельствах стала очевидной необходимость наращивания мощностей производства вакцин на региональном уровне. При этом технология их производства должна быть доступной и мобильной, чтобы иметь возможность наладить выпуск вакцин в короткие сроки.
Интерес к мРНК-вакцинам обусловлен их эффективностью, безопасностью, быстротой производства, возможностью широкого масштабирования выпуска в условиях повышенного спроса, а также легкостью изменения антигенного состава выпускаемых вакцин в случае накопления значимых мутаций у вируса (Schlake et al. 2012). Ожидается, что с учетом освоения и активного использования технологии мРНК в производстве вакцин от COVID-19 многие производители классических вакцин также будут создавать препараты на основе мРНК, что ускорит их производство и повысит доступность.
Таблица 3. Характеристики разных типов вакцин от COVID-19 (Graham 2021)
| Характеристики | Векторные | ДНК | мРНК | Белковые | Цельновирионные |
| Быстрота производства | + | ++ | +++ | +/- | +/- |
| Рост на культуре клеток | + | — | — | + | + |
| Стабильность | ++ | ++ | +/- | + | + |
| Ранее лицензированы | +/- | — | — | + | ++ |
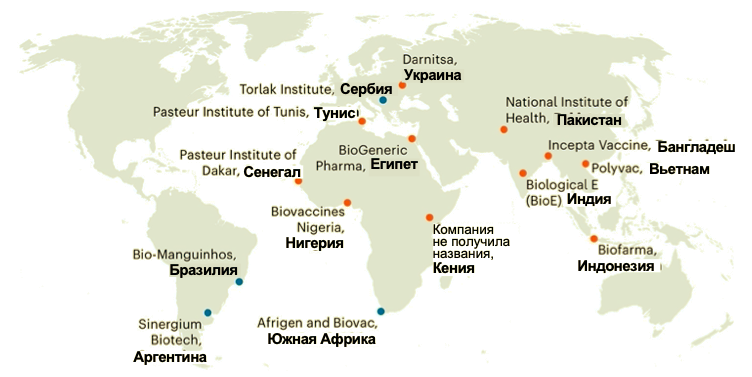
В 2021 году был создан Глобальный центр передачи технологий производства вакцин на основе мРНК для содействия производителям из стран с низким и средним уровнем дохода в освоении выпуска собственных препаратов за счет предоставления им всех технологических алгоритмов и ноу-хау, необходимых для массового изготовления вакцин в соответствии с международными стандартами (WHO 2021c). Несмотря на предыдущие успешные инициативы ВОЗ по справедливому распределению вакцин через механизм COVAX и передачу технологий в рамках двусторонних и многосторонних соглашений (через Пул доступных технологий для борьбы с COVID-19), инициатива по созданию центра передачи технологий производства вакцин на основе мРНК была признана эффективной стратегией в затронутых дефицитом регионах, которая позволит укрепить санитарно-эпидемиологическую безопасность на региональном уровне. Действующим ядром центра является южноафриканская компания Afrigen, а в настоящее время происходит передача технологии производства мРНК-вакцин от COVID-19 пятнадцати компаниям по всему миру (Maxmen 2022; см. Рис. 3). Центр, изначально созданный для противодействия чрезвычайной ситуации, связанной с пандемией COVID-19, обладает производственным потенциалом по выпуску вакцин и от других инфекций, что позволит странам самостоятельно решать, выпуск каких препаратов следует наладить для решения первоочередных задач в области охраны здоровья.
Выводы
На доступность вакцин от COVID-19 оказывают влияние многие условия: наличие регистрации препаратов в стране, их стоимость, эффективность цепочки поставок и распределения, определение стратегии вакцинации отдельных групп лиц, логистика предоставления вакцин с обеспечением низкого порога доступа, поддержание осведомленности и доверия населения к вакцинации.
Мировое сообщество оперативно среагировало на быстро возникшую потребность в вакцинах от COVID-19: новые разработчики и производители вакцин быстро нарастили объемы производства, были сокращены сроки клинических испытаний, осуществлено применение процедуры одобрения экстренного использования вакцин, появились национальные механизмы правового регулирования ускорения регистрации и ввоза препаратов в страну, для обеспечения равной доступности вакцин в странах с разным уровнем дохода была создана инициатива COVAX, обеспечены градация приоритетности предоставления вакцин отдельным категориям населения, а также снижение порога доступа к вакцинации.
Опыт решения задач, поставленных пандемией COVID-19, может быть перенесен и на другие области медицины, в том числе он может сыграть существенную роль в устранении глобального дефицита вакцин от прочих заболеваний. Перспективным представляется переход производства классических вакцин на мРНК-платформу, широкое использование опыта ускоренного вывода вакцин на рынок (процедура одобрения экстренного использования) и опыта межстрановых взаимодействий для поддержки стран с низким и средним уровнем дохода.
Список сокращений
ЕMA (European Medicines Agency) – Европейское агентство по лекарственным средствам
COVAX – касающаяся вакцин программа в рамках Инициативы по ускорению доступа к средствам для борьбы с COVID-19 (глобального сотрудничества, направленного на ускорение разработки, производства и равного доступа к тестам, вакцинам и препаратам для лечения COVID-19)
ВЕЦА – Восточная Европа и Центральная Азия
ВОЗ – Всемирная организация здравоохранения
мРНК – матричная или информационная, рибонуклеиновая кислота: вакцины содержат упакованную в липидную оболочку мРНК, кодирующую наиболее иммуногенную часть S-белка коронавируса, которая будет транслирована на рибосомах клетки-хозяина и вызовет развитие иммунного ответа
R0 – базовое репродуктивное число, оценивается как ожидаемое число вторичных случаев инфекции (то есть заразившихся от одного первичного источника инфекции) в восприимчивой популяции; является характеристикой быстроты распространения вируса, зависит от заразности вируса, частоты контактов восприимчивых лиц с источниками инфекции, времени наступления и продолжительности периода заразности, а также (в случае Re, эффективного репродуктивного числа) от накопленной доли невосприимчивых лиц в популяции
Источники
Закон Республики Беларусь от 18.06.1993 N 2435-XII «О здравоохранении» в редакции от 11.12.2020. (https://etalonline.by/document/?regnum=v19302435).
Закон Республики Беларусь от 20.07.2006 №161-З «Об обращении лекарственных средствах» в редакции Закона Республики Беларусь от 13.05.2020 г. №13-З. (https://www.pravo.by/upload/docs/op/H12000013_1589835600.pdf).
Постановление Министерства здравоохранения Республики Беларусь от 11.10.2021 г. №109 «Об изменении постановления Министерства здравоохранения Республики Беларусь от 17 мая 2018 г. № 42».
Постановление Совета министров Республики Беларусь от 8.10.2021 г. №570 «О государственной регистрации стратегически важных лекарственных препаратов».
Приказ Министерства здравоохранения Республики Беларусь от 12.10.2021 г. №1257 «О проведении вакцинации против инфекции COVID-19 женщин во время беременности и в период грудного вскармливания».
Приказ Министерства здравоохранения Республики Беларусь от 21.12.2021 г. №1615 «О проведении вакцинации детей против инфекции COVID-19».
Интернет-источники
Комитет по здравоохранению Мингорисполкома (2022). Пункты вакцинации. (https://komzdrav-minsk.gov.by) (10.06.2022).
Министерство здравоохранения Республики Беларусь (2020) Рекомендации для по вакцинации против COVID-19. (http://minzdrav.gov.by/ru/novoe-na-sayte/rekomendatsii-po-vaktsinatsii-protiv-covid-19) (18.02.2022).
Реестр лекарственных средств Республики Беларусь (2021) Гам-КОВИД-Вак, комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2. (https://www.rceth.by/Refbank/reestr_lekarstvennih_sredstv/details/10879_20_21). (06.06.2021).
BioNTech (2021) For a medicine of tomorrow. Annual report. (https://investors.biontech.de/static-files/7cbe565c-ac3e-4731-a0e8-a06d963098e0) (18.06.2022).
DCVMN, Developing Countries Vaccine Manufactures Network (2021) Vaccines – safeguarding our future. (https://www.dcvmn.org/IMG/pdf/directory_2021.pdf) (18.06.2022).
EMA (2021) COVID-19 vaccines. (https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-authorised) (01.12.2021).
GAVI (2022) COVAX Facility. (https://www.gavi.org/covax-facility) (18.06.2022).
Graham B. (2021) The immunological benefits of mRNA and potential applications. ADVAC meeting.(https://www.advac.org/images/files/alumni-meetings/2021-11-4-Presentation_Barney_Graham.pdf) (18.06.2022).
IVMA, Vaccine Manufacturer’s Association of India (2022) The Association.(http://ivma.in//association/) (18.06.2022).
Moderna, Inc. (2022) Moderna’s commitment to corporate social responsibility. (https://www.modernatx.com/responsibility/our-commitment) (18.06.2022).
NYT (2021) Coronavirus Vaccine Tracker. (https://www.nytimes.com/interactive/2021/world/covid-vaccinations-tracker.html) (01.12.2021).
Ritchie, H., Mathieu, Ed., Rodés-Guirao, L., Appel, C., Giattino, Ch., Ortiz-Ospina, E., Hasell, J., Macdonald, B., Beltekian, D., Roser M (2022) Coronavirus Pandemic (COVID-19). OurWorldInData.(https://ourworldindata.org/coronavirus) (18.06.2022).
WHO (2005) International Health Regulations, Third Edition.(https://www.who.int/publications/i/item/9789241580496) (6.06.2021).
WHO (2016) Addressing the global shortage of medicines and vaccines. World Health Assembly, 69.(https://apps.who.int/iris/handle/10665/252805) (6.06.2021).
WHO (2020a) Emergency Use Listing Procedure, Version 13. (https://cdn.who.int/media/docs/default-source/medicines/eulprocedure_a63b659c-1cdc-4cee-aa2d-ef5dd9d94f0b.pdf?sfvrsn=55fe3ab8_7&download=true) (18.06.2022).
WHO (2020b) SAGE values framework for the allocation and prioritization of COVID-19 vaccination.(https://apps.who.int/iris/bitstream/handle/10665/334299/WHO-2019-nCoV-SAGE_Framework-Allocation_and_prioritization-2020.1-eng.pdf?ua=1) (18.06.2022).
WHO (2020c) SAGE roadmap for prioritizing use of covid-19 vaccines. (https://cdn.who.int/media/docs/default-source/immunization/sage/covid/sage-prioritization-roadmap-covid19-vaccines-ru.pdf?sfvrsn=bf22744336&download=true) (18.06.2022).
WHO (2021a) Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process.(https://www.who.int/teams/regulation-prequalification/eul/covid-19) (06.06.2021).
WHO (2021b) Prequalified vaccines. (https://extranet.who.int/pqweb/vaccines/prequalified-vaccines) (06.06.2021).
WHO (2021c) The mRNA vaccine technology transfer hub. (https://www.who.int/ru/initiatives/the-mrna-vaccine-technology-transfer-hub) (18.06.2022).
WHO (2022) Draft landscape of COVID-19 candidate vaccines.(https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines) (04.05.2022).
Библиография/References
Maxmen, A. (2022) Unseating big pharma: the radical plan for vaccine equity, Nature, Vol. 607. Nо7918, p. 226–233.
Offit, P.A. (2022) Covid-19 Boosters – Where from Here? New Engl J Med, Vol. 386, p.1661–1662.
Schlake, T., Thess, A., Fotin-Mleczek, M., Kallen, K.J. (2012) Developing mRNA-vaccine technologies, RNA biology, Vol. 90. Nо 11, p. 1319–1330.
Thomson, A., Robinson, K., Vallée-Tourangeau, G. (2016) The 5As: A practical taxonomy for the determinants of vaccine uptake, Vaccine, Vol. 34 No.8, p. 1018–1024.
